Степень окисления
Атомы химических элементов могут проявлять различную валентность, т.к. могут присоединять различное число атомов других элементов. Валентность характеризует способность атомов соединяться с другими атомами.
Валентностью называется число одинарных связей, которые атом образует с другими атомами в молекуле. Под числом химических связей понимают число общих электронных пар. Общие электронные пары образуются только в случае ковалентной связи, поэтому валентность атомов можно определить только в ковалентных соединениях.
Высшая валентность химического элемента обычно равняется номеру группы, в которой он находится.
В большинстве случаев валентность равняется числу неспаренных электронов в атоме. Неметаллические элементы могут проявлять разные валентности.
Атом хлора в обычном состоянии проявляет валентность равную І (содержит один неспаренный электрон).
Рассмотрим соединения HCl, HBr, NaBr.
- К какому элементу сдвинута общая электронная пара в каждом случае?
- В каком случае существует полный переход электронов от одного атома к другому? Какому типу химической связи это соответствует?
Запишите структурные формулы и укажите сдвиг электронной плотности
В ионных кристаллах нет общих электронных пар, поэтому для веществ с ионной связью понятие валентности не существует.
Для всех классов соединений, независимо от вида химической связи, применяют понятие "степень окисления".
Степень окисления – это условный заряд, который приписывают химическим элементам, составляющим вещество, исходя из предположения об ионном характере химической связи.
Степень окисления указывает на количество частично или полностью смещенных электронов от одного атома к другому в соединении.
Более электроотрицательный элемент присоединяет электроны и приобретает отрицательный заряд. Отрицательная степень окисления равна числу электронов, которые приняты данным атомом (проявляется только у неметаллов). Атомы неметаллов присоединяют то количество электронов, которое не достает до завершения уровня и равно номеру группы минус 8.
Положительная степень окисления равна числу электронов, которые отданы данным атомом. Атом может отдать все валентные электроны, соответствующие номеру группы, в которой находится элемент, при этом проявляя высшую степень окисления (исключение OF2).
- Степень окисления свободных атомов и простых веществ равна 0: (
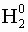 ; Mg0)
; Mg0) - Степень окисления водорода в соединениях с неметаллами равна +1, а с металлами равна -1: (NaH-1, H+1Cl).
- Степень окисления фтора в соединениях всегда равна -1: (HF-1, CaF-12).
- Степень окисления кислорода в соединениях равна -2 (NO-2, Al2O-23), а в пероксидах -1 (H2O-12, O+1F2)
- Степень окисления металлов в соединениях всегда положительная , у металлов I-A, II-A, III-A соответственно равна +1, +2, +3 .
- Суммарная степень окисления всех атомов в молекуле равна 0.
- Высшая степень окисления элемента равна (+№ группы).
- Низшая степень окисления: для металлов равна 0, для неметаллов равна (№ группы -8).
- Элементы в высшей степени окисления могут только принимать электроны
- Элементы в низшей степени окисления могут только отдавать электроны
- Элементы в промежуточной степени окисления могут и принимать, и отдавать электроны.
Комментариев нет:
Отправить комментарий